Блоги
Нанотехнологии в терапии рака Кричевский Г.Е.,
От автора
Закончил работу над трехтомником «Зеленые и природоподобные технологии – основа устойчивого развития для будущих поколений». Первый том вышел в конце июня 2019 года, второй – в ноябре, третий выйдет в начале 2020 года. В первом томе изложены основы зеленых технологий, зеленой химии, зеленой энергетики, возрождения природных красителей и полимеров, бионика. Второй том посвящен зеленым технологиям биосинтеза благородных и тяжелых металлов. Третий том содержит главы о наномедицине, телемедицине, зеленом текстиле. Эта статья является переработанной главой третьего тома об использование нанотехнологий, наноматериалов и наночастиц в лечении онкологических заболеваний.
Введение
Научные достижения последних 15-20 лет в области биологии, генной инженерии, инженерии тканей, нанотехнологии, фундаментальной медицины значительно расширили наше представление о механизмах возникновения и лечение онкологических заболеваний. Стало ясно, что причиной заболевания рака является ряд генетических заболеваний, изменение внешних условий (экология, образ жизни и др.), что приводит к аномальному, неконтролируемому делению клеток и способности развивать ими свое кровоснабжение. Сценарий развития рака очень сложный и будет рассмотрен дальше. Традиционная терапия рака не добилась ожидаемых результатов, не справившись с очень сильными побочными негативными эффектами, ухудшающими качество жизни пациентов. При этом нанотехнологии в медицине (наномедицина) позволили качественно повысить эффективность технологии лечения рака. Появилось понятия – термин «наномедицина». Нанотехнологии, наноматериалы, наночастицы стали использоваться в медицине в нанотерапии. Разработаны структуры нанотранспортеров, наполненных препаратами и векторами, имеющими сродство к онкологическим клеткам. В результате появилась вторая фаза развития онкотерапии с помощью агрессивных адресных (таргетных) онкопрепаратов, обладающих и лечебными и диагностическими функциями. Появились новые виды онкотерапии, основанные на использовании наночастиц определенной химической природы. Это магнитная гипертермия, фототермическая терапия, радиочастотная гипертермия.
О раке
Рак является основной проблемой здоровья человека в XXI веке. Каждый год 7,6 млн человек умирает от рака, при этом 70% летальных случаев от этой цифры приходится на развивающиеся страны. Это и понятно, там более тяжелые условия жизни, низкий уровень медицины, нездоровый образ жизни. Рак возникает и развивается в результате неуправляемого клеточного деления аномальной онкоклетки или в результате превращения здоровых клеток в клетке с аномальными свойствами. Основные факторы, определяющие возникновение и развитие рака: наследственные мутации клеток или мутации, вызванные внешними факторами (окружающая среда, радиоизлучение, ультрафиолетовое излучение, токсичные химические вещества, курение, алкоголь, наркотики и др.). Виды рака очень разнообразны, более 100 видов и каждый из них возникает под действием не одного только фактора. Считается, что все виды рака возникают в результате сложных биологических реакций на молекулярном уровне, изменяющих нормальные функции здоровых клеток.
Предполагаемой механизм возникновения и развития рака
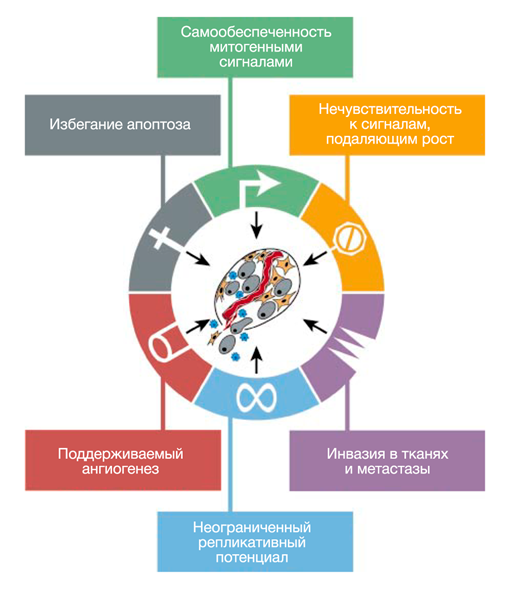
Выявлено 6 видов изменений в функциях здоровых клеток, когда они превращаются в раковые (рис.1): – проявление самодостаточности сигнала роста; – не чувствительность клеток к сигналам остановки роста клеток; – проявление неограниченного репликативного механизма; – игнорирование необходимости гибели (apostas) клеток; – проявление устойчивого онтогенеза развития кровеносных сосудов; – тканевая инвазия (распространение онкоклеток в соседние ткани; – метастазирование – миграция онкоклеток через кровеносную и лимфатическую системы в отдельные органы и ткани.
Рис. 1. Шесть приобретенных способностей рака. Большинство видов рака приобрели эти функциональные возможности во время развития опухоли.
Это, конечно, самый общий механизм возникновения и развития онкологических заболеваний. Знание интимных механизмов для читателей (и писателей) этой статьи не требуется.
Онкологическая терапия
В настоящее время онкологические заболевания лечат следующими традиционными методами, с которыми многие, к сожалению, знакомы: хирургия, лучевая терапия, фотодинамическая терапия, химическая терапия. Хирургия. Обычно используется в случае удаления опухолей большого объёма, а также на ранних стадиях рака. Не рекомендуется в случае расположение больших опухолей по соседству с жизненно важными органами и случае наличия метастаз. Также операция нецелесообразна в случае многочисленных опухолей в различных органах. Лучевая терапия использует излучение лучей с высокой энергией, которая убийственна для компонентов онкологических клеток (ДНК, РНК, ферменты, рибосомы и др.). Лучевая терапия бывает: – контактной (брахитерапия), когда радиоактивный источник размещен рядом (в контакте) с опухолью; – телетерапия, когда источник излучения α или β излучения находятся на расстоянии от онкологической опухоли. Иногда открытый источник (радиоактивный) используется для лечения (щитовидная железа). Фотодинамическая терапия основана на доставке фотоактивных химических веществ, чаще всего красителей определенного строения и цвета, в онкологическую опухоль. После этого опухоль с фотоактивным веществом облучают светом с длиной волны, которую поглощает фотоактивное вещество. Поглощая свет в видимой и УФ части спектра, фотоактивное вещество приходит возбужденное состояние. Последнее переводит кислород в энергетически активное синглетное состояние и генерирует радикальные частицы. Возникает синглетный кислород и радикалы деструктируют составляющие онкологической клетки и приводят их гибели. Традиционная химическая терапия заключается в использовании онкологических препаратов «ядохимикатов» – цитостатиков, способных приостанавливать рост и убивать клетки любой природы (онкологические, микроорганизмы и здоровые). Задача заключается в доставке онкологических препаратов в опухоль к онкологическим клеткам. К сожалению, независимо от формы приема онкологические препараты (орально, перорально, инъекции в вену), попадая в организм больного и проходя по кровеносной и лимфатической системам, они попадают не только в опухоль, но и в различные ткани и органы и накапливаются в них в той степени, в которой онкопрепараты имеют сродство к этим органам и тканям. И, конечно, повреждают их, как и онкологические клетки. Задача создателей онкологических препаратов – сконструировать молекулу препарата так, чтобы она в большей степени накапливалась в онкологической опухоли, а не в здоровых тканях и органах. Иначе происходит существенное снижение качества жизни больного. Поскольку онкологические препараты сильно сорбируются, накапливаются в тканях желудочно-кишечного тракта, в клетках костного мозга, в фолликулах волос, то это вызывает рвоту, выпадение волос и другие неприятности. Эти побочные эффекты традиционной химиотерапии могут быть успешно преодолены нанотерапией.
Наномедицина в лечении рака
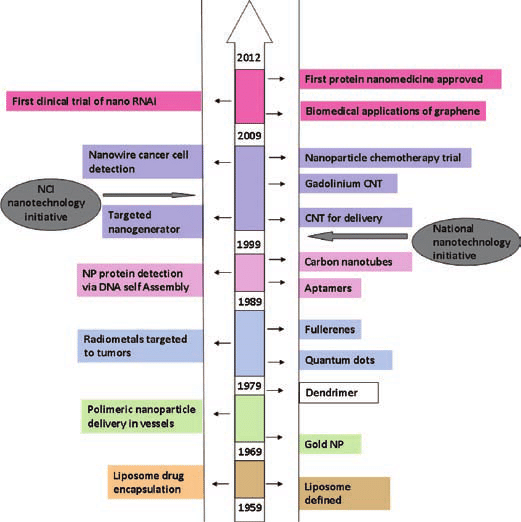
Нанотехнология начала интенсивно развиваться, начиная с середины прошлого века, и в настоящее время используется как таковая и как ее продукты – наноматериалы и наночастицы различной химической природы. Нанотехнологии, наноматериалы, наночастицы используются практически во всех областях науки, техники и в обыденной каждодневной жизни. Современная медицина тоже активно использует наночастицы, нанотехнологии и наноматериалы во многих своих областях (нанотерапия, нанодинамическая фармация, телемедицина). Очень часто нанотехнологии используются совместно с информационными и когнитивными технологиями, что обеспечивает существенный эффект синергии и, как следствие, усиление эффективности лечения. Эти достижения не обошли стороной и технологии химиотерапии, появился термин и целое направление – наноонкология. На рисунке 2 показаны этапы развития наноонкологии в течение последних 50-ти лет.
Рис. 2.
Были сформулированы принципы и цели использования наноонкологии, которые легли в систематические исследования во всём мире по разработке эффективных, нетоксичных, многофункциональных онкологических препаратов. Требования к онкопрепаратам: – многофункциональность (лечение, диагностика); – повышенная лечебная активность; – высокая избирательность (селективность) по отношению к патологическим клеткам, тканям, опухолям; – измененная фармакокинетика; – управляемый синтез: – отсутствие или пониженная иммуногенность; – контролируемая скорость и полнота высвобождения самого лечебного агента; – стабильность в условиях. Таким образом, поставив целью достижения этих свойств, подошли к созданию адресных наноонкопрепаратов. Первым делом начали поиск наноматериалов и наносистем, которые можно было бы нагружать молекулами, способными убивать раковые клетки. При этом наночастицы выполняли бы роль нанотранспортеров, благодаря своим малым размерам способным преодолевать биологические барьеры. А в качестве непосредственно онкологического агента могут быть использованы традиционные химиоонкологические препараты, которые крепятся к нанотранспортеру химическими связями или просто заполняют структурные ниши нанотранспортера. В качестве нанотранспортера используют наночастицы различной природы (низкомолекулярные, полимерные, органические, неорганические, гибридные и др.). Конкретно в качестве нанотранспортеров успешно используют липосомы, дендримеры, фуллерены, наночастицы благородных и тяжелых металлов. Однако такой препарат, включающий в себя нанотранспортер и сам онкологический агент, не будет обладать адресными (таргетными) свойствами. Тут требуются особые хитрости в дизайне наноонкопрепарата.
Пассивная и активная таргетность
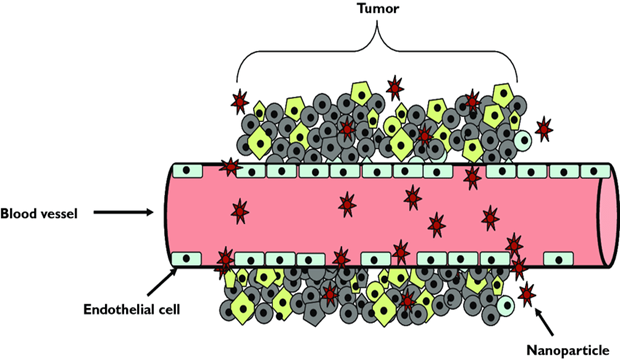
Разделяют пассивную и активную таргетность. Пассивная (менее эффективная) таргетность достигается за счет малого наноразмера нанотранспортера, загружаемого онколекарствами, которые попадают в раковую опухоль за счет малого размера (высокая проникающая способность) и специфической структуры морфологии раковых клеток и кровеносных сосудов, подходящим к ним (рис. 3).
Рис. 3.
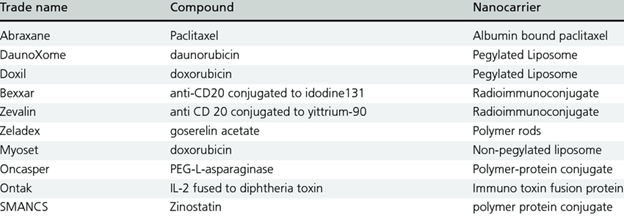
Эта специфика раковых опухолей, клеток и кровеносных сосудов обеспечивает удержание онкологических препаратов в опухоли и в клетках. В табл.1 приведены характеристики таргентных пассивных препаратов, разрешенных FDA.
Таблица 1.
Активная таргетность обеспечивается присоединением к нанотранспортеру помимо лекарства ещё и очень важной функциональной группы – вектора, имеющего сродство к рецепторам определенного строения на поверхности раковой клетки. Это средство обеспечивает избирательность всего онкологического препарата к раковой опухоли. Благодаря вектору, препарат проходит через органы и ткани организма, не повреждая их, но достигнув опухоли, высвобождается, собирается на поверхности онкологических клеток, взаимодействуя со специфическими рецепторами на их поверхности. Продырявливая, деструктируя стенку онкологической клетки, препарат повреждает все составляющие клетки (ДНК, РНК, и др.), убивает её. И этот механизм схож с тем, как снаряд со встроенной автоматической системой наведения находит свою цель, имея к ней сродство («любовь») (рис. 4).
Рис. 4.
Факторы, влияющие на эффективность таргетирования
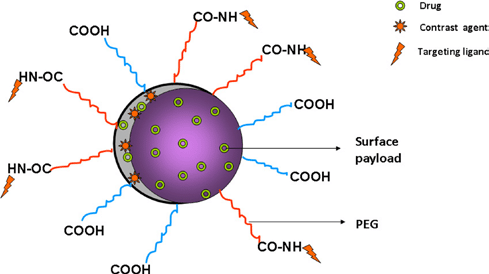
Поскольку нанотранспортеры в таргетных препаратах являются наночастицами, то свойства всего терапевтического комплекса, его подвижность, проникающая способность зависят от характеристик нанотранспортеров. Свойства наночастиц, как известно, зависят от их химической природы, размера, распределения по размерам, формы и поверхностного заряда. Эти же параметры и характеристики влияют на таргетность всего комплекса использования таргетных комплексов. На платформе нанотранспортеров открывают большие возможности подбирать необходимые параметры, изменяя химическую природу, размер, форму и заряд нанотранспортера. Важную роль играет размер нанотранспортера, поскольку от него зависит поглощение препарата онкологическими клетками. Причём обнаруживаются критические наноразмеры, при которых лечебный эффект максимальный. Чаще всего это размер 40-60 нм. От размера наночастиц зависит кинетика и поглощение препарата онкологическими клетками. Форма нанотранспортеров также играет роль в таргетности лечебного комплекса, поскольку от неё зависит возможность сорбции препарата на поверхности онкологической клетки (пространственная комплементарность). Заряд лечебного комплекса играет роль во взаимодействии с поверхностью онкологической клетки, которая часто имеет заряд, чаще всего отрицательный. Знак заряда клетки зависит от наличия на её поверхности групп, способных диссоциировать адсорбированные ионы, содержащиеся в физиологической жидкости окружающий клетки, и от pH внешней среды. С учетом вышесказанного дизайн таргетного препарата конструируют, вводя в него тоже ионогенные группы. Лиганды-векторы, определяющее свойство таргетности могут и часто имеют заряд, который передают всему таргетному комплексу. В качестве лигандов-векторов используют различные активные биомолекулы, сообщающие всему этому комплексу сродство к раковым клеткам. Например, фолиевую кислоту, тиамин, антитела. Кроме того, для улучшения растворимости и других полезных свойств комплекс соединяют (коньюгируют) с белками, полисахаридами, жирными кислотами, с синтетическими ДНК и РНК. В конъюгировании используют ПЭГ, улучшающий растворимость таргетного комплекса.
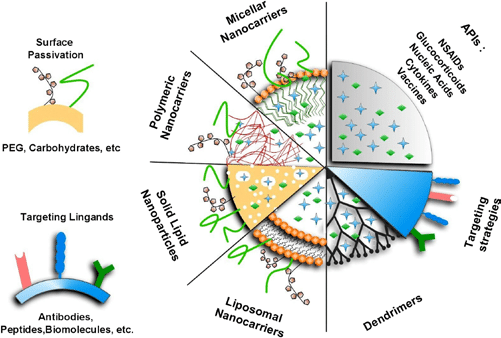
Основные виды нанотранспортеров, используемых в качестве платформы таргетных препаратов
Липосомы – коллоидные наноструктуры в форме шара, которые образуются самосборкой. Липосомы состоят из липидного (или билипидного) слоя и центрального водного ядра. Активный терапевтический агент загружают в водное ядро липосомы. Липосомная наноформа таргетного (пассивного) более активна в химиотерапии, чем просто «голый» цитостатик, и обеспечивает снижение негативных побочных явлений. Онкопрепарат в практической химиотерапии рака использует следующие липосомные формы: циторабин, аннамицин, доксорубицин, daunorubicin+cytarabine. Полимеры как нанотранспортеры очень удобны для конструирования таргетных препаратов, поскольку они легко нагружаются активными онколекарствами, биосовместимы, биодеградируемы, обеспечивают стабильность готового онкологического лекарства, легко высвобождают последние в зоне раковой опухоли. Используют как синтетические, так и природные полимеры, которые легко химически модифицируются для придания полезных свойств. В качестве синтетических полимеров используют полимолочную кислоту, полигликолевую кислоту, поликапролактон, а в качестве биополимеров полиглутаминовую кислоту, белки и полисахариды. Часто для придания растворимости готовой форме онкологического препарата его поверхность покрывают гидрофильным полимером ПЭГ. Полимерной форме онкологического препарата можно путем химической модификации придавать многофункциональность, например, вводить не один, а несколько лиганд-векторов для связи с раковыми клетками разной природы. Или присоединение молекул синглетного характера (магнитные, электрические, спектральные свойства). Тогда препарат будет не только лечить, но и диагностировать расположение опухоли. Дендримеры – хорошо известные в химии сложные молекулы с разветвлённой древовидной структурой, состоящей из ядра, ветвей и функциональных групп на концах ветвей. В полости дендримеров можно включать гидрофильные и гидрофобные активные цитостатики, поскольку дендримеры содержат и гидрофобное ядро, и гидрофильные поверхности (рис. 5). Дендримеры, как и наночастицы, хороши тем, что их размером от 1 до 10 нм можно управлять при синтезе за счет добавления и удлинения ветвей.
Рис. 5.
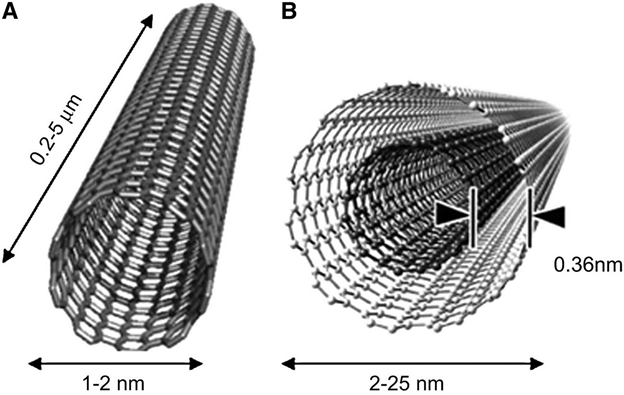
Молекулы дендримеров можно легко химически модифицировать, придавая им полезную функциональность. В дендримеры можно водить наночастицы благородных металлов, обладающих цитостатическими свойствами. Известные онкологические комплексы на основе платформы дендримеров, наполненных активным онкологическим лекарствами – доксирубицин и цисплатин. Мицеллы как нанотранспортеры – это коллоидная система самоорганизующихся частиц дифильного характера. Обычно так себя ведут поверхностно-активные вещества, образуя при определенных концентрациях (критическая концентрация ККМ) структуры различной формы, состоящие из гидрофобной и гидрофильной частей. Размер мицелл на полимерной основе составляет 10-6-10-7 м, что значительно меньше, чем мицеллы ПАВов. В качестве полимеров как нанотранспортеров используют сложные полиэфиры, простые полиэфиры и полиаминокислоты, образующие гидрофобную часть мицеллы. В качестве гидрофильной части используют остатки пропиленоксида, в полимолочной кислоты, поликапролактона, полиаспарагиновой кислоты. Комбинация таких нанотранспортеров с традиционными цитостатиками (5-фторурацил, гемцитабин, паклитакселом) дает лучший лечебный эффект при лечении различных видов рака, чем цитостатики в чистом виде. Снижаются их побочные эффекты, влияющие на качество жизни. Использование вирусов в качестве нанотранспортеров. Вирусы (лат. Virus – яд) – это природные наночастицы, паразиты неклеточного строения, развивающиеся внутри клеток и состоящие из молекул нуклеиновых кислот ДНК и РНК (но никогда вместе). Вирусы – самые многочисленные биологические объекты. Размножаются только в клетке хозяина, паразитируют в организме клетки. Вирусы имеют множество видов, имеют разные размеры и форму (Ø=20-300 нм). В качестве нанотранспортеров используют вирус мозаики и бактериофаги, пожирающие бактерии. Преимуществом вирусов в качестве платформы для онкологического комплекса являются его наноразмеры и способность легко проникать в клетки, в том числе онкологические. Углеродные наноструктуры в качестве нанотранспортеров. В качестве углеродных наноструктур используют углеродные нанотрубки одностенные и многостенные. Их поверхность, как правило, модифицируют для придания полезных свойств, а затем соединяют с цитостатиками. На рис. 6 показана структура углеродных трубок.
Рис. 6.
Неорганические наночастицы. Наночастицы благородных и тяжелых металлов. Наночастицы благородных и тяжелых металлов широко используются в медицине в терапии и диагностике рака. В последние 15 лет получило широкое развитие экологичного «зеленого» биосинтеза наночастиц благородных и тяжелых металлов и их окислов. В трехтомике Г.Е. Кричевского «Зелёные и природоподобные технологии – основа устойчивого развития для будущих поколений» во втором и третьем томах подробно описаны зеленые технологии биосинтеза наночастицы благородных и тяжелых металлов и их использование в медицине и в онкотерапии. Наночастицы металлов обладают способностью проникать в раковые опухоли разной природы, прикрепляться к поверхности клетки опухоли, дырявить её, проникать внутрь клетки и поражать там весь аппарат репликации и роста клеток (ДНК, РНК, ферменты, рибосомы). Сочетание в онкологическом комплексе наночастиц металлов с цитостатиками дает хорошие результаты в лечении рака разного вида. В качестве наночастиц металлов используют золото, серебро, железо, медь, никель, кобальт, платину, окислы металлов. Наночастицы фосфатов кальция Ca3(PO4)3 содержатся в костях и зубах человека, поэтому биосовместимы и биоразлагаемы, являются хорошими нанотранспортерами для доставки нуклеиновых кислот, с которыми образует комплекс с участием ионов кальция Са+2 и фосфатной группы нуклеиновых кислот, имеющих отрицательный заряд. Наночастицы фосфата также используется для доставки цитостатиков «церамид», «цисплатин», «метатрексат» и «доцетаксел».
Последнее поколение наномедицины в онкологии
Последние 10-15 лет наномедицина сфокусировалась на создании таргетных препаратов и таргетной химиотерапии. Основой этих онкологических комплексов являются нанотранспортеры вышеперечисленных видов, нагруженных цитостатиками и функционализированных прикрепленными лигандами-векторами и сигнальными группами. Такие комплексы не взаимодействуют со здоровыми органами, тканями и клетками, «невидимками» доходят до онкологических опухолей и только в ней высвобождают цитостатик-токсин для онкологических клеток. Одновременно наличие сигнальных групп в комплексе позволяет детектировать локальное расположения опухоли. Такие таргетные лечебные и диагностические комплексы называют тераностиками.
Специфика лечение метастазированного рака с помощью нанотерапии
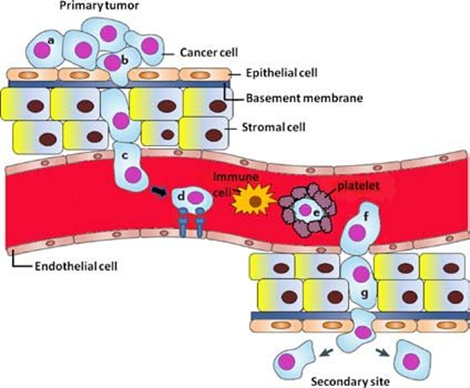
Метастазирование (миграция онкологических клеток из опухоли в другие ткани и органы) является одной из самых сложных проблем в онкологии. Для борьбы с метастазами не подходит хирургия и химиотерапия опухолей. На основании понимания механизма, картины кровотока можно прогнозировать из каких раковых опухолей и куда могут мигрировать онкологические клетки, образуя метастазы. На рис. 7 схематично показан механизм метастазирования через кровоток из первичной опухоли в другие органы.
Рис. 7.
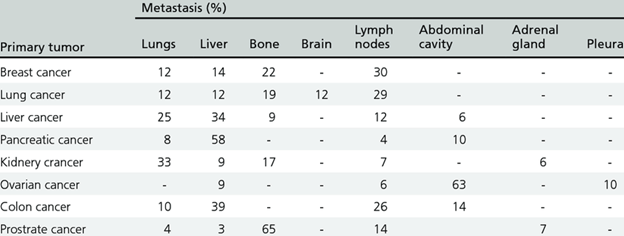
В таблице 2 показано из каких опухолей органов и куда метастазирует онкологические клетки. Таблица 2.
Для подавления метастаз необходимо создавать лечебные онкологические комплексы, учитывающие особенности их морфологии. Конструируют комплексы определенного размера, заряда и химического строения. Иногда выбирают первичное и вторичное нацеливание на метастазирование орган. Наиболее трудно вылечиваются метастазы в мозге, легких, печени, костях. Вторым путем распространения метастаз является лимфатическая система, и в этом случае лечение еще больше осложняется. Требуется подбирать в качестве нанотранспортеров частицы определенного размера (~80 нм), способные перемещаться в лимфатические узлы. Печень является излюбленным органам, где развиваются метастазы, потому что этот орган имеет очень развитую систему кровеносных сосудов.
Физические методы в наноонкологии
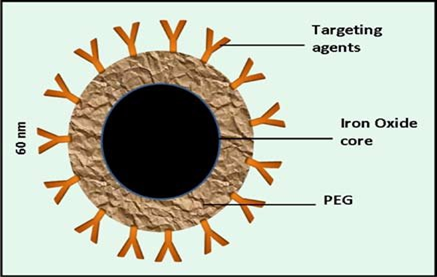
До сих пор обсуждались химические методы наноонкологии. Параллельно им развивались и физические методы с использованием наночастиц. К таким методам относят гипертермические методы, заключающиеся в том, чтобы убить, остановить рост раковых клеток, воздействуя на них нагревом до температуры 41-43°С. Задача заключается не в том, чтобы прогреть весь организм, а локально только раковую опухоль. Для этого выбирают химические вещества наноразмеров таргетного, адресного действия, обладающие такими физическими свойствами, которые позволяют при действии на них физических полей разной природы локально нагреваться. Это похоже на ранее описанную фотодинамическую терапию. Для теплового воздействия на опухоль используют облучение волнами на радиочастотах, микроволновое, магнитное поле, ультразвук, фотооблучение. Гипертермия вызывает денатурацию всех белков мембраны онкологических клеток, ферментов, плазмы (тоже белки) и хромосомных белков. Это приводит к гибели раковых клеток. При температуре 50-60°С в клетке происходят процессы, похожие на ожог, клетка «выжигается». Показано, что раковые клетки более чувствительных к нагреву, чем здоровые. Большую роль в современной технологии гипертермии играют наночастицы, обладающие уникальными свойствами поглощения энергии при физическом воздействии на них. Поглощая энергию, переводя её в тепловую, «разогревая» онкологические клетки опухоли наночастицы играют роль «серебряных пуль», способных убивать только раковые клетки. Дизайн онкологических комплексов при лечении методом гипертермии такой же как и в случае таргетных онкологических препаратов, то есть нанотранспортеров с лигандами-векторами, с сигнальными молекулами, а вместо активного цитостатика комплекс нагружается наночастицами, способными поглощать энергию. Используют наночастицы, способные нагреваться в магнитном поле при облучении светом (видимые и УФ волны), радиочастотными и микроволнами. В магнитной терапии используются наночастицы, обладающие магнитными свойствами при воздействии переменного магнитного поля, которые производят нагревание окружающей среды (онкоклетка). В магнитной гипертермии используют следующие наночастицы: – ферриты (CoFe2O4, MnFe2O4, NiFe2O4 и др.); - ферромагнитные наночастицы (Fe, Au, оксиды Fe и др.); – супермагнитные наночастицы оксида железа Fe3O4 и др. На рис. 8 схематично показана структура супермагнитной наночастицы, которая в ядре содержит окись железа, а с оболочкой из ПЭГ связаны лиганды-векторы, обеспечивающие таргетность.
Рис. 8.
Фототермическая терапия. При облучении светом наночастицы благородных и тяжелых металлов проявляется квантовое явление резонанса (плазмонного поглощение света). При этом происходит коллективное колебание проводящих электронов наночастиц металлов и трансформация энергии света в тепло. Это свойство зависит от размера и формы наночастиц металлов. Поэтому наночастицы металлов, в том числе золото Au и серебро Ag, меняют цвет окраски в зависимости от размера и формы. Это свойство интуитивно использовали средневековые мастера, изготавливая цветные витражи, вводя в состав стекла золото Au и серебро Ag. Радиочастотная гипертермия – подведение к опухоли радиочастотного облучения в настоящее время производится нижеописанным образом. Электрод от генератора радиоволн через кожу водятся в опухоль при контроле наведения. От генератора радиоволн подаётся переменный ток (375-500 кГц) в опухоль. Обеспечивают напряжение, при котором создается в опухоли нагрев до температуры 45°С. Тепло генерируется за счет быстрого колебания ионов в радиочастотном поле. Недостатком этого вида терапии является неравномерность нагрева опухоли по объему и площади. Наибольшей нагрев происходит на конце электрода и снижается к периферии, поэтому этот вид терапии используют для терморазрушения опухоли малого размера ~ 5-6 см. Проблемы неравномерности нагрева решаются, если в опухоль таргетно доставить наночастицы, поглощающие радиочастотное облучение. Такими наночастицами являются одностенные углеродные трубки размером ~1 нм и наночастицы золота Au. Одностенные углеродные трубки функционализируют химической модификацией с целью придания им растворимости и биосовместимости. Хорошие результаты радиочастотная гипертермия даёт в случае рака кожи и других видов рака, когда опухоль расположена близко к поверхности кожи, поскольку в этом случае радиоволны легче проникают в них. Интересный вид радиочастотный гипертермии предложил и реализовал у себя дома Д.Конзиус (сам больной лимфомой). Устройство состоит из радиочастотного генератора переменной мощности (0-2 кВт), соединяющееся с системой, состоящей из двух головок – передающий и принимающий. Это устройство позволяет производить облучение в горизонтальном и вертикальном режиме, формируя поле облучения до 30 см, с максимум интенсивности с диаметром 7 см.
Заключение
Традиционная химиотерапия рака по своей природе использования цитостатиков – ядохимикатов, проявляющих токсичность по отношению не только к онкологическим, но и к здоровым клеткам, существенно снижает качество жизни больных при её использовании. Достижения современной нанотехнологии (разнообразные наноматериалы и наночастицы) позволяют существенно снизить побочные эффекты традиционной химиотерапии. Это достигается синтезом нанотранспортеров, выступающих в качестве подвижной платформы для таргетных онкологических комплексов, нагруженных эффективными цитостатиками и несущих лиганды-векторы (направляют препарат к клетке) и диагностирующие сигнальные группы. Такой бифункциональный препарат (тераностик) позволяет производить и диагностику, и лечение рака. Варьируя строение нанотранспортеров, цитостатика, лиганда-вектора можно эффективно лечить рак разного вида. Этот прогресс может быть достигнут за счёт междисциплинарного подхода с использованием последних достижений биологии, биотехнологии, нанотехнологии, информационных технологий и, конечно, медицины и молекулярной инженерии. Пока все методы наномедицины дороги и не для всех доступны, но это проблема социальных технологий, являющихся функционалом государства. На горизонте прослеживается принципиально иной подход к проблеме рака и других заболеваний генного характера. Не терапия, а предупреждение с помощью генной инженерии, исправляющее ошибки природы на молекулярном и клеточном уровнях.
Рекомендуемая литература
1. Г.Е. Кричевский. «Зеленые и природоподобные технологии – основа устойчивого развития для будущих поколений». Два тома вышли в 2019 году, третий том выйдет в начале 2020 года. 2. Г.Е. Кричевский. «БИОНИКА. Учимся мудрости у природы» (2015 г.). 3. Г.Е. Кричевский. «Все или почти всё о текстиле» (трехтомник 2011-2013 г.). 4. Г.Е. Кричевский. «Нано-, био-, химические технологии и производство нового поколения волокон, текстиля и одежды» (2011 г.). 5. Г.Е. Кричевский. «Возрождение природных красителей» (2017 г.). 6. Г.Е. Кричевский. «НБИКС (нано-, био-, инфо-, когно-, социогумманитарные) технологии для МИРА и ВОЙНЫ» (2017 г.). 7. Hanan, D., Weinberg, R. A. “Hallmarks of cancer: The next generation”, Cell, doi: 10.1016.2011.02.013, 2011. 8. Lemmon, M. A., Schlessinger, J. “Cell signaling by receptor tyrosine Kinases”, Cell, 141, pp. 1117–1134, 2010. 9. Witsch, E., Sela, M., Yarden, Y. “Roles for growth factors in cancer Progression”, Physiology (Bethesda) 25(2), pp. 85–101, 2010 10. Hayflick, L. “Mortality and immortality at the cellular level, A review”, Biochemistry, 62(11), pp. 1180–1190, 1997. 11. Talmadge, J. E., Fidler, I. J. “AACR centennial series: the biology of cancer metastasis: historical perspective”, Cancer Res. 70(14), pp. 5649–5669, 2010. 12. Kateb, B., Chiu, K., Black, K. L., Yamamoto, V., Khalsa, B., Ljubimova, J. Y., Ding, H., Patil, R., Portilla-Arias, J. A., Modo, M., Moore, D. F., Farahani, K., Okun, M. S., Prakash, N., Neman, J., Ahdoot, D., Grundfest, W., Nikzad, S., Heiss, J. D. “Nanoplatforms for constructing new approaches to cancer treatment, imaging and drug delivery: what should be the polic?”, Neuroimage, 54, pp. S106–S124, 2011. 13. Scheinber, D. A., Villa, C. H., Escorcia, F. E., McDevitt, M. R. “Conscripts of the infinite armada: systemic cancer ther-apy using nanomaterials”, Nature Reviews, 7, pp. 266–276, 2010. 14. Chithrani, B. D., Ghazani, A. A., Chan, W. C. “Determining the size and shape dependence of gold nanoparticle uptake into mammalian cells”, Nano Lett. 6(4), pp. 662–668, 2006. 15. Jiang, W., Kim, B. Y., Rutka, J., Chan, W. C. “Nanoparticle-mediated cellular response is size-dependent”, Nat. Nanotechnol. 3, pp. 145–150, 2008. 16. Fox, M. E., Szoka F. C., Fréchet J. M. “Soluble polymer carriers for the treatment of cancer: the importance of molecular architecture”, Acc. Chem. Res. 42, pp. 1141–1151, 2009. 17. Zhang, K., Fang, H., Chen, Z., Taylor, J. S., Wooley, K. L. “Shape effects of nanoparticles conjugated with cell-penetrating peptides (HIV Tat PTD) on CHO cell uptake”, Bioconjug. Chem. 19(9), pp. 1880–1887, 2008. 18. Gratton, S. E., Ropp, P. A., Pohlhaus, P. D., Luft, J. C., Madden, V. J., Napier, M. E., Desimone, J. M. “The effect of particle design on cellular internalization pathways”, Proc. Natl. Acad. Sci. USA 105, pp. 11613–11618, 2008. 19. Verma, A., Uzun, O., Hu, Y., Hu, Y., Han, H, Watson, N., Chen, S., Irvine, D. J., Stellacci, F. “Surface-structure-regulated cell membrane penetration by monolayer-protected nan-oparticles”, Nat. Mater. 7, pp. 588–595, 2008. 20. Suh J., Choy, K., Lai, S. K., Suk, J. S., Tang, B., Prabhu, S., Hanes, J. “PEGylation of nanoparticles improves their cytoplasmic transport”, Int J Nanomedicine, 2(4), pp. 735–741, 2007. 21. Portilla-Arias, J. A., Garcia-Alvarez, M., Galbis, J. A., Munoz-Guerra, S. “Biodegradable nanoparticles of par-tially methylated fungal poly (beta-L-malic acid) as a novel protein delivery carrier”, Macromol. Biosci. 8(6), pp. 551–559, 2008. 22. Lockman, P. R., Mumper, R. J., Khan, M. A., Allen, D. D. “Nanoparticle technology for drug delivery across the blood–brain barrier”, Drug Dev. Ind. Pharm. 28(1), pp. 1–13, 2002. 23. Kateb, B., Chiu, K., Black, K. L., Yamamoto, V., Khalsa, B., Ljubimova, J. Y., Ding, H., Patil, R., Portilla-Arias, J., Modo, M., Moore, D. F., Farahani, K., Okun, M. S., Prakash, N., Neman, J., Ahdoot, D., Grundfest, W., Nikzad, S., jheiss, J. D. “Nanoplatforms for constructing new approaches to cancer treatment, imaging and drug delivery: what should be the policy?”, Neuroimage, 54, S(1), pp. 106–124, 2011. Комментарии:Пока комментариев нет. Станьте первым! |